三级淋巴结构 (Tertiary lymphoid structures, TLSs) 是出生后在非淋巴组织中形成的免疫细胞的有组织聚集体。TLSs不存在于生理条件下,而是在包括自身免疫性疾病、慢性感染和癌症等环境下出现。TLSs以被CD3+ T 细胞包围的CD20+ B 细胞结构为特征,类似于次级淋巴器官(secondary lymphoid organs, SLOs)中的淋巴滤泡,此外,还包含不同的树突细胞群、致密的基质网络还有被认为可以介导淋巴细胞募集的由外周淋巴结地址素 (peripheral node addressin, PNAd)和高内皮小静脉(high endothelial venules, HEV)提供的特殊脉管系统等组成部分。
除少数例外,肿瘤中TLSs的存在与免疫治疗后更好的预后和临床结局相关,尽管被认为很重要,但其形成的驱动因素以及这些结构对肿瘤内免疫反应的贡献仍未完全了解。
近期,来自荷兰癌症研究所的Daniela S. Thommen和Ton N. Schumacher教授在Science杂志上发表了一篇题为Tertiary lymphoid structures in cancer 的综述,他们在这篇文章中详细讨论了目前对于TLSs在癌症中作用的了解,具体包括:1)TLSs 形成的驱动因素;2)TLSs对抗肿瘤免疫反应的功能和贡献,以及 3)TLSs在人类癌症中作为治疗靶点的潜力。

1. TLSs 形成的驱动因素
包括淋巴结、脾脏、扁桃体等在内的SLOs遍布全身,允许从不同组织采集抗原,以促进适应性免疫反应的诱导。在持续慢性炎症的情况下,淋巴组织发生结外播种,从而导致在非淋巴组织中形成TLS。因此,将TLS与胚胎发生过程中SLO的形成进行对比可能是有助于理解TLS的形成过程。SLO形成是在胚胎发育早期通过造血淋巴组织诱导(lymphoid tissue inducer, LTi)细胞、CD4+ CD3- CD45+ 先天淋巴细胞定植于淋巴结间叶组织开始的,LTi细胞的聚集以依赖于肿瘤坏死因子(TNF)家族成员的方式驱动SLO形成的初始步骤,淋巴毒素α1β2 (LTα1β2) 也在其中发挥核心作用。LTα1β2和TNF与间充质淋巴组织的组织(lymphoid tissue organizer, LTo)细胞上各自的受体LTβR和TNFR1结合,从而促进调节HEV血管形成的血管细胞粘附分子1(VCAM1)和细胞间粘附分子 1(ICAM1),以及一组包括CCl19、CXCL13等调节免疫细胞向淋巴生态位募集的趋化因子的产生。随后CCL19+ 和/或 CCL21+ FRCs 和 CXCL13+ FDCs 指导表达相应 CCR7 和 CXCR5 受体的淋巴细胞的分布,从而分别形成T 细胞和 B 细胞区。
虽然在解剖结构上,TLS与SLO具有明显的相似性,但大多数TLS缺乏周围的包膜,这种特征允许它们的细胞成分直接进入周围组织,同时也能够使 TLS 驻留的免疫细胞暴露于来自炎症微环境的大分子。关于TLS的启动,至少到目前,还不清楚是否需要LTi细胞或发挥LTi作用的替代细胞,比如与经典LTi细胞共享RORγt转录因子的TH17细胞,以及在慢性炎症环境中也可以充当LTi作用的效应 CD8+ T 细胞、NK细胞、B细胞等。值得注意的是,与SLO不同,TLS的诱导可能并不总依赖于淋巴毒素,例如LTa-/-小鼠中确实会出现淋巴聚集物,虽说这些结构并未显示出T和B细胞的分区且缺乏HEV,因而可能不认为是符合定义的TLS。除了替代的LTi细胞,也有一些研究证明局部基质和免疫细胞也可能充当LTo细胞的“替身”。
有趣的是,不同细胞因子和趋化因子可以诱导小鼠产生具有不同特征的TLS,例如CXCL13的组织特异性表达诱导缺乏滤泡树突细胞网络的B细胞聚集体,而TNF和CXCL12表达诱导主要由B细胞和少量T细胞组成的淋巴细胞浸润。然而,需要注意的是,大部分可用数据来自使用不一致的标记来描述TLS成分的研究,因此需要进行规范化的、使用相同参数集进行的大规模分析,从而允许对癌症之间的TLS异质性进行严格评估(图1)。
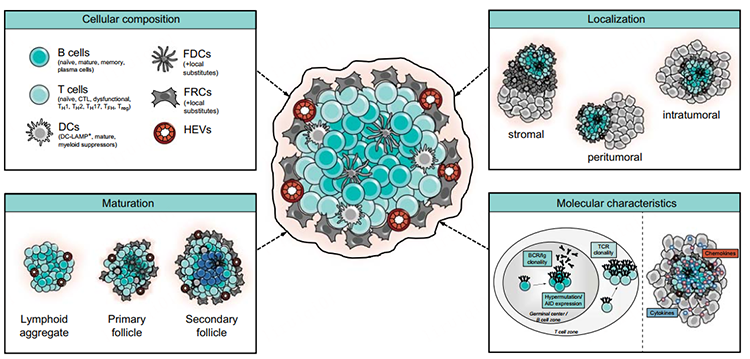
除了支持存在不同类型的TLSs的证据之外,关于TLS,肿瘤之间还有一个重要区别在于有些肿瘤伴随TLS形成,而有些则不伴随,因此了解肿瘤在哪些条件下支持或不支持TLS形成很重要。简单来说,TLS出现在慢性炎症部位,一些观察表明它们的形成与B和T细胞在这些部位的抗原识别有关,例如在人类黑色素瘤和卵巢癌转移以及原发性乳腺癌和胃食管癌中,在显微切割的TLS中观察到B细胞的克隆扩增和免疫球蛋白的体细胞超突变和同种型转换,进一步强化了局部抗原驱动的B细胞反应的概念。类似地,TLS的形成同样与抗原特异性T细胞反应的存在有关,例如在非小细胞肺癌中,TLS的数量显示与CD8+和CD4+T细胞中的克隆优势相关,而人肺癌中的肿瘤反应性富含于寡克隆功能失调的PD-1highCD8+T细胞亚群,这些PD-1highT细胞主要在TLS中观察到。尽管上述研究确定了许多影响肿瘤微环境中TLS形成的因素,但对是否利于TLS形成的局部环境的特定分子决定因素的理解仍知之甚少。
2. TLSs对抗肿瘤免疫反应的功能和贡献
越来越多的证据表明,适应性免疫反应也可以在TLS中产生或增强。TLS中与B细胞相关的主要效应功能之一是产生疾病相关抗体,这些抗体可以标记抗原表达细胞的调理作用、补体介导的裂解或抗体依赖性细胞毒性。已发现TLS中的生发中心形成与血清自身抗体浓度、疾病严重程度和几种自身免疫性疾病的器官功能下降相关。同样,与黑色素瘤中的其他肿瘤驻留T细胞相比,已在TLS内的T细胞上观察到激活标志物的表达增加,但一个重要的未解决问题是TLS是否主要用于重新激活效应T细胞,或者它们是否主要支持幼稚T细胞的启动。已有研究报道了特别是在TLS形成的最早阶段效应T细胞的募集,这表明效应群体的“再教育”可能发生在TLS中,但也有研究表明在非肥胖糖尿病小鼠的胰岛中存在幼稚T细胞到TLS的募集,缺乏淋巴结的LTa缺陷小鼠的TLS可以在没有SLO的情况下诱导B和T细胞的反应。这些发现说明TLS可以在原位复制SLO的功能。
基于这些发现,人们想知道在发炎部位存在TLS的价值是什么?猜想1是“速度”,T和B细胞的局部启动可能会加速免疫反应,然而TLS通常在“慢性”炎症中凸显,“速度”的猜想似乎不太令人信服;猜想2是“效率”,局部淋巴生态位的产生可能会增加疾病相关抗原和稀有匹配淋巴细胞之间相遇的可能性,从而可能能够诱导更强烈或更广泛的免疫反应;猜想3是“控制”,拥有与发炎组织部位直接接触的淋巴生态位可能会提供额外的机会来引导免疫反应;猜想4是“存活”,TLS相关成纤维细胞和其他细胞亚群分泌的存活因子支持TLS中的淋巴细胞稳态,并且可能有助于肿瘤反应性T细胞在肿瘤部位的长期持续存在。
3. TLSs在人类癌症中作为治疗靶点的潜力
TLS与许多癌症类型的良好预后相关,且肿瘤中TLS的存在通常伴随着免疫浸润的普遍增加,与单独的CD8+T细胞浸润相比,TLS和活跃的肿瘤内CD8+T细胞浸润的组合与更好的预后相关。研究发现,TLS 成熟状态或位置的异质性可能会影响其预后价值。具体而言,与淋巴聚集的患者相比,携带具有原发性或继发性滤泡样分化的 TLS 的肝细胞癌或结直肠癌患者的复发风险较低。关于 TLS 位置,大多数研究报告了肿瘤周围 TLS 的存在,但在肝细胞癌、肾细胞癌的肺转移瘤中被发现存在肿瘤内的TLS。在肝细胞癌中,与瘤内 TLS 相比,肿瘤周围 TLS 的存在与更高的癌症复发风险和不利结果相关,但在大多数癌症中,尚未确定 TLS 的肿瘤周围或肿瘤内位置与预后之间的明确关联。
值得注意的是,TLS的存在也与某些癌症的进展相关,比如主要存在于 TLS 中的 Treg 的消耗改善了小鼠肺腺癌模型中的肿瘤控制,这表明 TLS 相关的 Treg 可能抑制内源性抗肿瘤 T 细胞反应。一项 HCC 祖细胞在形成肝肿瘤之前首先出现在 TLS 中的观察结果提出 TLS 作为可能促进恶性细胞转化和生长的微生态位。已在人类乳腺癌的 TLS 中检测到癌细胞簇,它们的存在与淋巴浸润和更高的淋巴结分期有关。尽管上述观察结果为影响其预后价值的 TLS 组成的异质性提供了证据,但促进肿瘤进展的“抑制性”TLS 存在的直接证据仍然有限。
最近的一些研究也提供了 TLS 对免疫检查点阻断(ICB)反应的预测价值的证据。具体而言,已显示在黑色素瘤、肾细胞癌等治疗前活检中存在 TLS 和活跃的 B 细胞浸润与对 PD-1 或联合 PD-1 加CTLA-4阻断反应相关。同样,大量 TLS 成分,包括记忆样 B 细胞和浆母细胞样细胞,在黑色素瘤中 ICB 应答者的治疗前活检中富集。而对治疗中肿瘤活检的分析表明,ICB 治疗也可以促进 TLS 的形成,在高危黑色素瘤和尿路上皮癌的新辅助ICB 后,与匹配的治疗前样本相比,响应患者的肿瘤显示出更高数量的 TLS 相关 B 细胞。
考虑到TLS与疾病结局的关联,诱导TLS可能会成为一种有吸引力的治疗策略。在乳腺癌和神经内分泌胰腺癌的小鼠模型中获得了 TLS 可经治疗诱导产生并与肿瘤遏制相关的证据,其中 PD-L1 阻断与抗血管生成疗法的结合导致肿瘤血管转化为 HEV,伴随着TLS 形成、上调的 CD8+ T 细胞刺激和肿瘤破坏。已在人类癌症中观察到不依赖于 ICB 的 TLS 诱导(图2),例如在患有高级别宫颈上皮内瘤变的患者中,在接种人乳头瘤病毒癌蛋白疫苗后可以在消退后的病变中观察到 TLS 的形成和 TLS 的克隆扩增。类似地,用辐照的同种异体粒细胞-巨噬细胞集落刺激因子分泌型胰腺肿瘤疫苗(GVAX疫苗)联合环磷酰胺进行治疗性疫苗接种可导致绝大多数胰腺癌患者形成TLS。
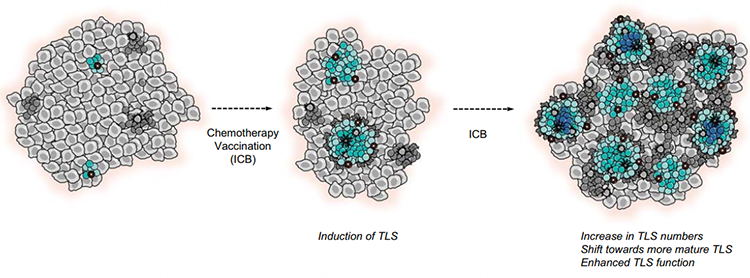
图2. 通过新辅助化疗和ICB可诱导或促进癌症中 TLS 的形成。
总结
最近对TLS在癌症中的预后和预测价值的研究激发了人们对其作为抗肿瘤免疫的潜在介质的兴趣。尽管 TLS 已在多种癌症类型中被探究,并且其预后价值毋庸置疑,但使用一致的标志物来定义和表征 TLS 应该成为未来关注的一个领域,以最大限度地发挥这些结构作为潜在生物标志物的价值。就此而言,更全面的 TLS 表征可能有助于根据细胞组成、位置、成熟度和功能等方面提供“TLS 状态”谱的定义(图 1)。最后,更详细地了解 TLS 功能及其在自身免疫毒性中的潜在作用将有助于了解其作为治疗靶点的价值。
原文链接:
https://doi.org/10.1126/science.abf9419













